


|

| 产地 | American |
| 品牌 | AAT Bioquest |
| 货号 | CS22971 |
| 用途 | Research Grade |
| 包装规格 | 200 Tests |
| 纯度 | 98%% |
| CAS编号 | |
| 是否进口 | 是 |
线粒体是细胞超氧化物的主要生产者。低中等水平的超氧化物的产生对于许多重要细胞过程的适当调节至关重要,这些过程包括基因表达,信号转导和肌肉对耐力运动训练的适应性。不受控制的线粒体超氧化物的产生会触发细胞氧化损伤,从而导致多种疾病的发病机理,包括癌症,心血管疾病,神经退行性疾病和衰老。Cell Meter 荧光法线粒体过氧化物检测试剂盒使用我们独特的超氧化物指示剂来定量活细胞中的超氧化物水平。MitoROS 580具有活细胞渗透性,可以快速,选择性地靶向线粒体中的超氧化物。与超氧化物反应时会生成红色荧光。Cell Meter 荧光法线粒体过氧化物检测试剂盒提供了一种灵敏的一步荧光测定法,可在培养一小时后检测活细胞中的线粒体超氧化物。该试剂盒可用于荧光酶标仪和荧光显微镜应用。
适用仪器
| 流式细胞仪 | |
| 激发: | 540nm |
| 发射: | 590nm |
| cutoff: | 570nm |
| 推荐孔板: | 黑色透明 |
| 读取模式: | 底读模式 |
样品实验方案
简要概述
溶液配制
储备溶液配制
工作溶液配制
将25μL的500X MitoROS 580储备溶液添加到10 mL的测定缓冲液(组分B)中,并充分混合以制成MitoROS 580工作溶液。 注意:此MitoROS 580工作溶液在室温下至少可稳定2小时。
实验步骤
在所需的缓冲液(例如PBS或HHBS)中,用10 μL 10X测试化合物(96孔板)或5 μL 5X测试化合物(384孔板)处理细胞。 对于对照孔(未处理的细胞),添加相应量的化合物缓冲液。
为了诱导超氧化物,将细胞板在37°C下孵育所需的时间,避光。 注意:我们在37°C下用50 μM抗霉素A(AMA)处理HeLa细胞30分钟,以诱导超氧化物。 有关详细信息,请参见图1。
将100 μL /孔(96孔板)或25 μL /孔(384孔板)的MitoROS 580工作溶液添加到细胞板中。
将细胞在37°C下孵育30至60分钟。
使用荧光酶标仪(Ext / Em = 540/590 nm(Cutoff = 570 m))检测荧光强度,或者使用带有TRITC滤光片的荧光显微镜观察细胞。
图示
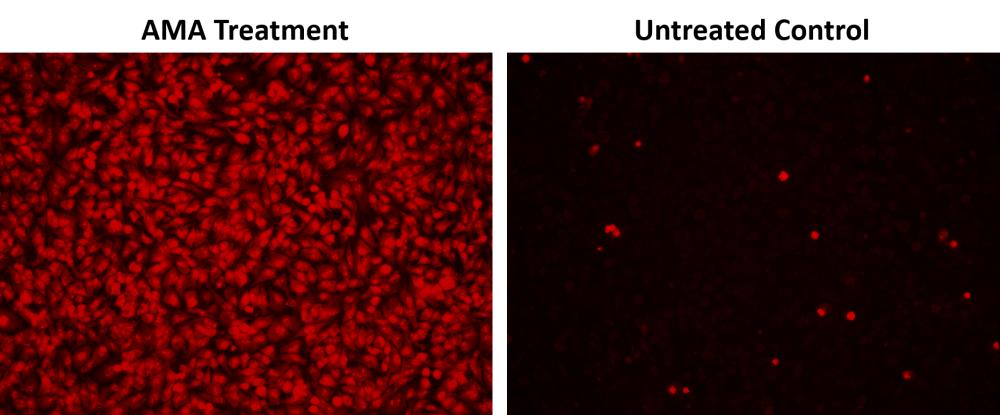
图1.使用Cell Meter 荧光细胞内超氧化物检测试剂盒(Cat#22971)在HeLa细胞中测量超氧化物的荧光图像。 将100,000个细胞/孔/ 100 μL的HeLa细胞在96孔黑色板中接种过夜。 AMA处理:将细胞在37°C下用50 μM抗霉素A(AMA)处理30分钟,然后与MitoROS 580孵育1小时。 未经处理的对照:HeLa细胞与MitoROS 580在37°C下孵育1小时,未经AMA处理。 使用带有TRITC滤光片的荧光显微镜检测荧光信号。 |

图2.使用Cell Meter 荧光细胞内超氧化物检测试剂盒(Cat#22971)检测HeLa细胞中的细胞内超氧化物。 将100,000个细胞/孔/ 100 μL的HeLa细胞在96孔黑色板中接种过夜。 将细胞与50 μM绿脓素(Pyo)孵育; 50 μM抗霉素A(AMA)或未经处理(对照)在37oC下放置30分钟。 然后将细胞与MitoROS 580在37℃孵育1小时。 使用CLARIOstar酶标仪(BMG Labtech)以底部读取模式在Ex / Em = 540/590 nm(截止= 570 nm)下检测荧光信号。 |
参考文献
Concentration-dependent effect of sodium hypochlorite on stem cells of apical papilla survival and differentiation
Authors: Martin DE, De Almeida JF, Henry MA, Khaing ZZ, Schmidt CE, Teixeira FB, Diogenes A.
Journal: J Endod (2014): 51
Effect of hypochlorite oxidation on cholinesterase-inhibition assay of acetonitrile extracts from fruits and vegetables for monitoring traces of organophosphate pesticides
Authors: Kitamura K, Maruyama K, Hamano S, Kishi T, Kawakami T, Takahashi Y, Onodera S.
Journal: J Toxicol Sci (2014): 71
A simple yet effective chromogenic reagent for the rapid estimation of bromate and hypochlorite in drinking water
Authors: Zhang J, Yang X.
Journal: Analyst (2013): 434
Analysis of the germination kinetics of individual Bacillus subtilis spores treated with hydrogen peroxide or sodium hypochlorite
Authors: Setlow B, Yu J, Li YQ, Setlow P.
Journal: Lett Appl Microbiol (2013): 259
Comparative antimicrobial activities of aerosolized sodium hypochlorite, chlorine dioxide, and electrochemically activated solutions evaluated using a novel standardized assay
Authors: Thorn RM, Robinson GM, Reynolds DM.
Journal: Antimicrob Agents Chemother (2013): 2216
Effect of hypochlorite-based disinfectants on inactivation of murine norovirus and attempt to eliminate or prevent infection in mice by addition to drinking water
Authors: Takimoto K, Taharaguchi M, Sakai K, Takagi H, Tohya Y, Yamada YK.
Journal: Exp Anim (2013): 237
Green synthesis of carbon dots with down- and up-conversion fluorescent properties for sensitive detection of hypochlorite with a dual-readout assay
Authors: Yin B, Deng J, Peng X, Long Q, Zhao J, Lu Q, Chen Q, Li H, Tang H, Zhang Y, Yao S.
Journal: Analyst (2013): 6551
Use of pyrogallol red and pyranine as probes to evaluate antioxidant capacities towards hypochlorite
Authors: Perez-Cruz F, Cortes C, Atala E, Bohle P, Valenzuela F, Olea-Azar C, Speisky H, Aspee A, Lissi E, Lopez-Alarcon C, Bridi R.
Journal: Molecules (2013): 1638
A novel flow-injection analysis system for evaluation of antioxidants by using sodium dichloroisocyanurate as a source of hypochlorite anion
Authors: Ichiba H, Hanami K, Yagasaki K, Tanaka M, Ito H, Fukushima T.
Journal: Drug Discov Ther (2012): 44
Colorimetric determination of hypochlorite with unmodified gold nanoparticles through the oxidation of a stabilizer thiol compound
Authors: Zhang J, Wang X, Yang X.
Journal: Analyst (2012): 2806